??? 近日,國家藥品監督管理局經審查,批準了上海艾康特醫療科技有限公司生產的“硬性鞏膜接觸鏡”創新產品注冊�����。這是今年我市獲批的第4個第三類創新醫療器械。詳見↓
???????????????????????????????? ? ?
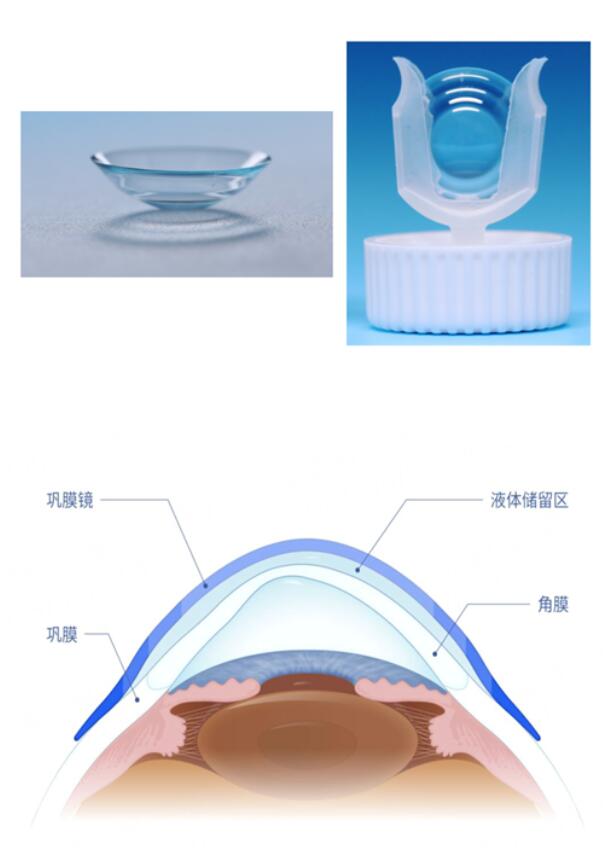
??? 該產品為日戴型硬性鞏膜接觸鏡����,是一種大直徑的硬性接觸鏡(俗稱“鞏膜鏡”)�,鏡片材料為氟硅丙烯酸酯(hexafocon A)���,著冰藍色��。該產品由光學區(OZ)���、中周區(PCCZ)����、角膜緣區(LCZ)和鞏膜著陸區(SLZ)四個弧段組成���,在臨床驗配時可通過對各弧段進行參數調整獲得更理想的鏡下液厚度�����,改善患者視覺質量的同時還可保護角膜組織。該產品創新性采用雙矢深非對稱設計,能夠更好地匹配不對稱鞏膜����;鞏膜著陸區為反轉弧面設計��,患者佩戴體驗更舒適。
??? 該產品適用于矯正不規則散光,或同時合并有+25.00D至-25.00D�,角膜規則散光小于5.00D的屈光不正患者���。該產品上市將為臨床治療提供更多選擇�。
??? 2022年4月���,該產品進入國家創新醫療器械特別審查通道��,至獲批上市期間�,國家藥監局醫療器械長三角分中心通過創新產品專人輔導機制,多次上門為創新企業提供“一對一、零距離”的咨詢指導服務�;市藥品監管局醫療器械注冊部門����、市器審中心將產品納入推薦前置服務范圍�����,主動跨前服務����,協助解決企業在產品研發�、檢測、注冊核查等環節的疑問,幫助企業少走彎路��,提高轉化效率���。
??? 藥品監督管理部門將加強該產品上市后監管�,保護患者用械安全。
??????????????????????????? ?? ?? ?
???? 今年�����,我市共有2個第二類�、4個第三類創新醫療器械獲批上市����。目前,我市共有81個醫療器械產品進入國家創新審查通道���;有37個第三類創新醫療器械獲批上市。
??? 近期�,市藥品監管局專門制訂《上海市服務生物醫藥創新發展工作方案》����,通過建立本市重點藥品����、醫療器械服務清單,對在研重點產品的臨床研究�、生產許可����、上市許可����、檢查檢驗等關鍵環節進行緊密對接,落實專人專班提前介入、主動對接、組團服務;對本市已進入和擬申請第二類或者第三類創新醫療器械特別審查程序的產品提供包括產品技術要求�、臨床評價��、設計轉化、生產質量管理體系等咨詢服務以及注冊跟蹤指導�����。進一步優化服務方式和工作程序��,推動“預查預檢”“全程網辦”“容缺受理”“即到即審”,將審評����、核查和檢驗等環節變串聯為并聯���,對關聯事項實行同審同辦����;提供第二類�����、第三類創新醫療器械申報資料預審查服務和部分補正預審查服務�,協助申請人與國家藥監局審評部門開展溝通交流��。通過服務創新產品��、創新技術的研發及注冊申報,幫助創新企業、創新行業發展����,推進創新產品注冊證書盡快落滬�,進一步激發區域產業創新活力,為打造生物醫藥區域發展高地提供支撐��。
?