省局機關有關處室���、各檢查分局,有關直屬單位:
??? 為持續深化“放管服”改革����,優化營商環境�����,做好全省藥品批發企業、藥品零售連鎖總部《藥品經營許可證》換證工作��。根據《中華人民共和國藥品管理法》《藥品經營和使用質量監督管理辦法》《藥品經營質量管理規范》《藥品檢查管理辦法(試行)》有關要求��,現制定印發《山西省藥品監督管理局<藥品經營許可證>換證工作方案》(見附件)�,請各有關處室和單位嚴格按照方案要求開展換證工作�,助推全省醫藥產業高質量發展。
山西省藥品監督管理局辦公室
2024年1月3日
(主動公開)
附件
山西省藥品監督管理局《藥品經營許可證》換證工作方案
為持續深化“放管服”改革����,優化營商環境��,做好全省《藥品經營許可證》換證工作,根據《中華人民共和國藥品管理法》《藥品經營和使用質量監督管理辦法》《藥品經營質量管理規范》《藥品檢查管理辦法(試行)》等法律法規�,結合我省藥品流通監管工作實際����,制定本方案��。
一���、工作原則
換證工作堅持依法行政���、風險研判����、分類實施的原則����,通過優化換證工作流程�����,夯實企業主體責任����,提高全省藥品經營環節質量管理水平��,保證人民群眾用藥安全有效可及�����,促進全省醫藥經濟高質量發展����。
二��、職責分工
省局藥品流通監管處負責制定全省藥品批發企業和藥品零售連鎖總部換發《藥品經營許可證》工作方案���;省局行政審批管理處負責按照工作程序開展資料受理���、流轉���,審核發放證件等工作���;省局執法監督與應急管理處負責對企業違法違規、被列入失信名單或負面清單情況的核查;各檢查分局負責對擬換發《藥品經營許可證》的第二類精神藥品經營企業提出是否現場檢查的意見�,加強企業換發《藥品經營許可證》后的跟蹤監管�����;省藥品檢查中心負責會同各檢查分局開展現場檢查,向省局行政審批管理處提交檢查結果報告等相關工作。
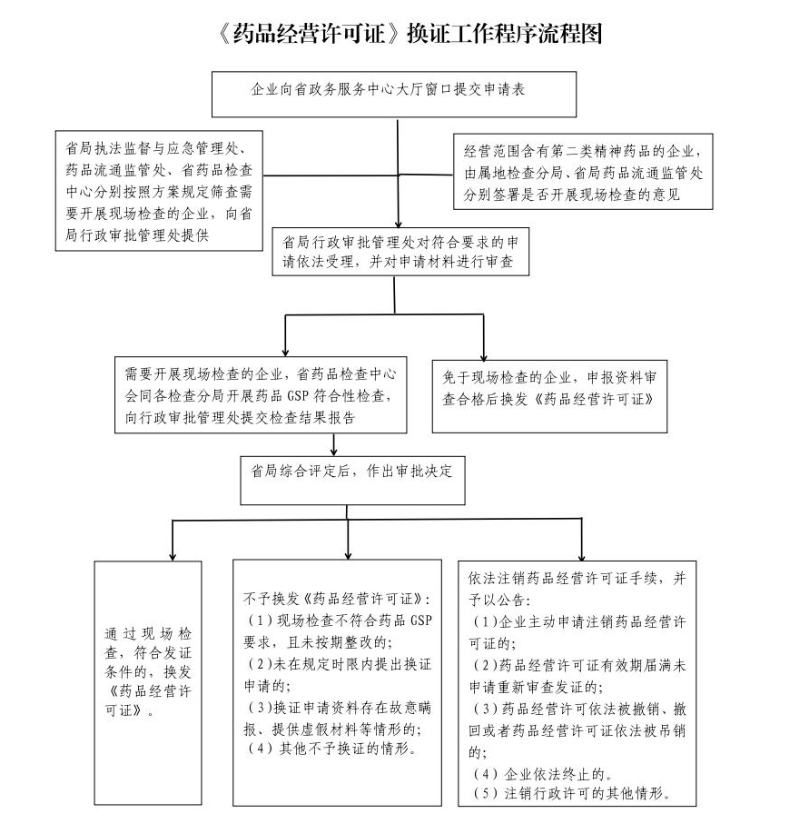
三、工作程序
(一)自查申報
擬換證企業對照藥品經營法律法規及藥品經營質量管理規范要求���,進行自查和整改,并在《藥品經營許可證》有效期屆滿前六個月至兩個月期間,向省政務服務中心大廳窗口提交申請表及相關資料(含附件)(登陸山西省政務服務網www.sxzwfw.gov.cn下載申請表并查閱申報資料要求)�。
(二)受理審查
省局行政審批管理處對符合要求的申請依法受理�����,并對企業申請材料進行審查。對于需要開展GSP符合性檢查的,依照《藥品檢查管理辦法(試行)》要求���,轉省藥品檢查中心會同各檢查分局組織開展GSP符合性檢查。對于免于現場檢查的,在對企業申報資料審查合格后換發《藥品經營許可證》。
企業因違法經營已被省局、檢查分局立案調查����,尚未結案的���;或者已經作出行政處罰決定���,尚未履行處罰的�;或者有投訴舉報事項未完成核查處置的��,行政審批管理處暫停受理其換發《藥品經營許可證》申請�����。
(三)審查要求
結合企業遵守藥品管理法律法規,GSP和質量管理體系運行情況����,根據風險管理原則,分類實施����。
1����、有下列情形之一的��,需進行現場檢查通過后換發《藥品經營許可證》:
(1)本持證周期五年內�,企業因違法行為受到藥品監管部門行政處罰的��;
(2)企業被市場監管等其它部門列入黑名單��、失信名單等負面清單的;
(3)本持證周期五年內�,企業接受藥品批發企業符合性檢查����,檢查結論為不符合要求或嚴重違反GSP的����;
(4)經營范圍含有麻醉藥品、第一類精神藥品���、藥品類易制毒化學品���、醫療用毒性藥品和罌粟殼經營企業�;
(5)從事疫苗委托儲存和運輸的企業�����;
(6)企業申請藥品經營許可證換發時���,同時申請經營范圍���、經營方式變更等需要開展現場檢查的項目����;
(7)本持證周期五年內��,企業有主動申請歇業�����、或因特殊原因停業的。
2�、經營范圍含有第二類精神藥品的企業���,由屬地檢查分局結合日常監管情況作出風險研判���,在《藥品經營許可證》換證審查表中簽署是否開展現場檢查的意見�,報省局藥品流通監管處會簽后轉行政審批管理處進行換證�����。
3�����、企業不存在上述情形,且符合換發《藥品經營許可證》條件的����,可免于現場檢查��,在對企業申報資料審查合格后換發《藥品經營許可證》���。
4���、在有效期屆滿前兩個月期間提出重新審查發證申請的�����,藥品經營許可證有效期屆滿后不得繼續經營���;經藥品監督管理部門準予許可后����,方可繼續經營��。
(四)審批發證
省局綜合評定后�����,作出審批決定。
1�����、對于符合條件的����,換發新證(新證自審批之日起��,有效期5年)����;
2、有下列情形之一的,不予換發《藥品經營許可證》:
(1)現場檢查不符合《藥品經營質量管理規范》要求��,且未按期整改的���;
(2)未在規定時限內提出換證申請的�����;
(3)企業換證申請資料存在故意瞞報���、提供虛假材料等情形的����;
(4)法律法規規定的其他不予換證的情形���。
3���、有下列情形之一的,由省局行政審批管理處依法辦理藥品經營許可證注銷手續,并予以公告:
(1)企業主動申請注銷藥品經營許可證的��;
(2)藥品經營許可證有效期屆滿未申請重新審查發證的�����;
(3)藥品經營許可依法被撤銷����、撤回或者藥品經營許可證依法被吊銷的��;
(4)企業依法終止的;
(5)法律��、法規規定的應當注銷行政許可的其他情形�。
四、工作要求
(一)各有關處室和單位要高度重視《藥品經營許可證》換發工作����,提前制定工作預案����,做好工作準備��,保障換證工作嚴格依規��、高質量推進。
(二)省局執法監督與應急管理處��、藥品流通監管處����、省藥品檢查中心分別按照方案規定對企業違法違規情況、被列入失信名單或負面清單情況��、未通過藥品GSP符合性檢查情況�����、停業歇業情況等進行篩查���,摸清需要開展現場檢查的企業名單����,向省局行政審批管理處提供�,準確按照方案要求分類開展換證工作。
(三)各檢查分局要結合《藥品經營許可證》換發工作�,做好對本轄區內藥品批發企業和藥品零售連鎖總部經營情況摸底���,提醒企業按照工作要求按時提交申請和相關資料�����;結合日常監管情況對第二類精神藥品經營企業是否需要現場檢查開展風險研判,提出公正客觀意見����;及時跟進排查本轄區內歇業超期���、經營異常����、停業企業等情況���,梳理建立風險檔案�����,切實規范企業經營行為����。
(四)省藥品檢查中心嚴格按照《藥品檢查管理辦法(試行)》及方案要求���,制定換證現場檢查和綜合評定工作流程�����,做好檢查方案制定、檢查員管理、檢查報告審核等工作����,會同各檢查分局按照藥品GSP等相關規定開展現場檢查����。
(五)省局行政審批管理處��、省藥品檢查中心及時將換證工作開展情況及具體企業信息推送藥品流通監管處�,加強溝通協作�����,做好審批和監管無縫銜接�����。
(六)各相關單位要把廉潔自律的要求�����,貫穿于換證工作全過程,嚴格依規依紀依法做好換證工作。要加強廉政教育�,組織相關人員學習法律法規和紀律規定����,開展政策解讀和廉政談話��,引導大家知敬畏���、存戒懼、守底線���,自覺遵守換證工作紀律和廉潔紀律,嚴格遵守“十條禁令”“十個嚴禁”�����。要加強監督檢查,緊盯關鍵崗位���、關鍵人員、關鍵環節,嚴肅處理違反中央八項規定精神和廉潔紀律等問題�,及時通報典型案例����,堅決杜絕違規違紀違法行為���,以有力有效的舉措確保換證工作風清氣正�。
本方案自印發之日起執行,國家藥品監督管理局另有規定的從其規定。
附件:1.《藥品經營許可證》換證審查表
2.《藥品經營許可證》換證工作程序流程圖
附件1?
《藥品經營許可證》換證審查表
|
企業名稱
|
|
|
許可證編號
|
|
許可證有效期
|
|
|
法定代表人
|
|
企業負責人
|
|
質量負責人
|
|
|
注冊地址
|
|
|
倉庫地址
|
|
|
經營范圍
|
|
|
五年內
接受符合性
檢查情況
|
簡述五年內接受符合性檢查(合規性檢查)檢查日期、檢查情況和檢查結論(相關檢查記錄、整改情況需蓋章作為附件一并提交)。
|
|
企業自查
|
自查項目
|
結論
|
|
本持證周期內是否受到藥品監管部門行政處罰
|
□是
|
□否
|
|
本持證周期內接受符合性(合規性)檢查是否符合要求
|
□是
|
□否
|
|
是否為從事疫苗委托儲存和運輸的雙方企業
|
£是
|
□否
|
|
是否未被市場監管等其它部門列入黑名單���、失信名單等負面清單
|
£是
|
□否
|
|
是否經營麻醉藥品��、第一類精神藥品���、第二類精神藥品����、藥品類易制毒化學品�、醫療用毒性藥品����、罌粟殼和放射性藥品
|
£是
|
□否
|
|
申請藥品經營許可證換發時,是否同時申請經營范圍��、經營方式變更等需要開展現場檢查的項目
|
£是
|
□否
|
|
本持證周期五年內,有無自主申請歇業或因特殊原因停業情況
|
£是
|
□否
|
|
經企業自查��,本公司經營符合《藥品經營質量管理規范》要求�����,并承諾對以上提交的資料真實性負責����,若存在真實性問題���,一切行政及法律責任由企業自行承擔��。
申請企業(公章):?????????????????法定代表人(簽名/章):
年???月 ??日
|
|
屬地檢查分局意見
|
(僅對經營范圍含有第二類精神藥品的企業���,簡要描述風險研判情況�����,提出是否開展現場檢查的意見)
檢查分局(簽字/公章):
年???月 ??日
|
|
省局藥品流通監管處意見
|
(僅對經營范圍含有第二類精神藥品的企業,簽署是否開展現場檢查的意見意見)
藥品流通監管處(簽字/公章):
年???月 ??日
|
附件2